Wasser ist die Grundlage allen Lebens auf der Erde. Über 70 Prozent der Erdoberfläche bestehen aus Wasser, und es spielt eine zentrale Rolle in unzähligen natürlichen Prozessen. Ohne Wasser wäre das Leben, wie wir es kennen, nicht möglich. Doch was macht Wasser so besonders? Es ist nicht nur das, was wir als Trinkwasser nutzen, sondern auch ein wesentliches chemisches Element, das unser Klima, die Natur und unseren Körper beeinflusst.
Die wichtigsten Fakten zu Wasser 💡
- Wasser bedeckt über 70 % der Erdoberfläche und ist die Grundlage allen Lebens.
- Es besteht aus zwei Wasserstoffatomen (H) und einem Sauerstoffatom (O) – chemische Formel H₂O.
- Wasser existiert in drei Zuständen: flüssig, fest (Eis) und gasförmig (Wasserdampf).
- Es ist ein Dipol-Molekül mit ungleicher Ladungsverteilung, was für seine hohe Oberflächenspannung verantwortlich ist.
- Eis ist weniger dicht als flüssiges Wasser, daher schwimmt es – diese Dichteanomalie sichert das Überleben von Lebewesen im Winter.
- Wasser hat einen neutralen pH-Wert von 7, was es ideal für viele chemische Prozesse macht.
Wasser besteht aus dem Wassermolekül H₂O, das sich aus zwei Wasserstoff-Atomen (H) und einem Sauerstoff-Atom (O) zusammensetzt. Diese Verbindung gibt Wasser seine einzigartigen Eigenschaften, die es zu einem entscheidenden Lebensbaustein machen. Egal, ob als Wasserdampf, flüssiges Wasser oder Eis – Wasser existiert in allen drei Zuständen und spielt in jeder Form eine zentrale Rolle in der Natur. In diesem Artikel werden wir uns ansehen, aus was Wasser genau besteht, wie es aufgebaut ist und warum es für das Leben auf der Welt so unersetzlich ist.

Aus was besteht Wasser?
Wasser ist eine einfache, aber faszinierenden Verbindung: H₂O. Diese chemische Formel bedeutet, dass jedes Wassermolekül aus zwei Wasserstoff-Atomen (H) und einem Sauerstoff-Atom (O) zusammengesetzt ist. Das Zusammenspiel dieser Atome verleiht Wasser seine besonderen Attribute, die es zu einem der wichtigsten Stoffe auf der Erde machen.
Die beiden Wasserstoffatome sind jeweils durch sogenannte kovalente Bindungen mit dem Sauerstoffatom verbunden. Das bedeutet, dass sich die Atome die Elektronen teilen, um eine stabile Verbindung zu bilden. Diese Art der chemischen Bindung sorgt dafür, dass das Wassermolekül stabil ist und in der Natur in vielen Zuständen vorkommen kann – sei es als flüssiges Wasser, Eis oder Wasserdampf.
Die Rolle des Sauerstoffatoms im Wassermolekül ist besonders wichtig, da es die Elektronen stärker zu sich zieht als die Wasserstoffatome. Dadurch entsteht eine ungleiche Ladungsverteilung, was das Wassermolekül zu einem Dipol macht. Dies führt zu den besonderen Wechselwirkungen zwischen den Wassermolekülen, die unter anderem für die hohe Oberflächenspannung des Wassers und viele andere seiner Eigenschaften verantwortlich sind.
Diese einfache, aber effektive chemische Struktur macht Wasser zu einem wesentlichen Lebensbaustein und sorgt dafür, dass es in vielen Prozessen unverzichtbar ist.
Suchst Du nach Nachhilfe Chemie? Finde die passende Lehrkraft auf Superprof!
Das Wassermolekül im Detail
Das Wassermolekül H₂O wird aus zwei Wasserstoffatomen und einem Sauerstoffatom gebildet. Diese drei Elemente sind so angeordnet, dass sie einen Winkel von etwa 104,5 Grad bilden. Dieser Winkel ist entscheidend für die Bedeutung des Wassermoleküls in der Natur. Durch die spezielle Form des Moleküls entsteht eine ungleiche Verteilung der elektrischen Ladung, was das Wassermolekül zu einem Dipol macht.
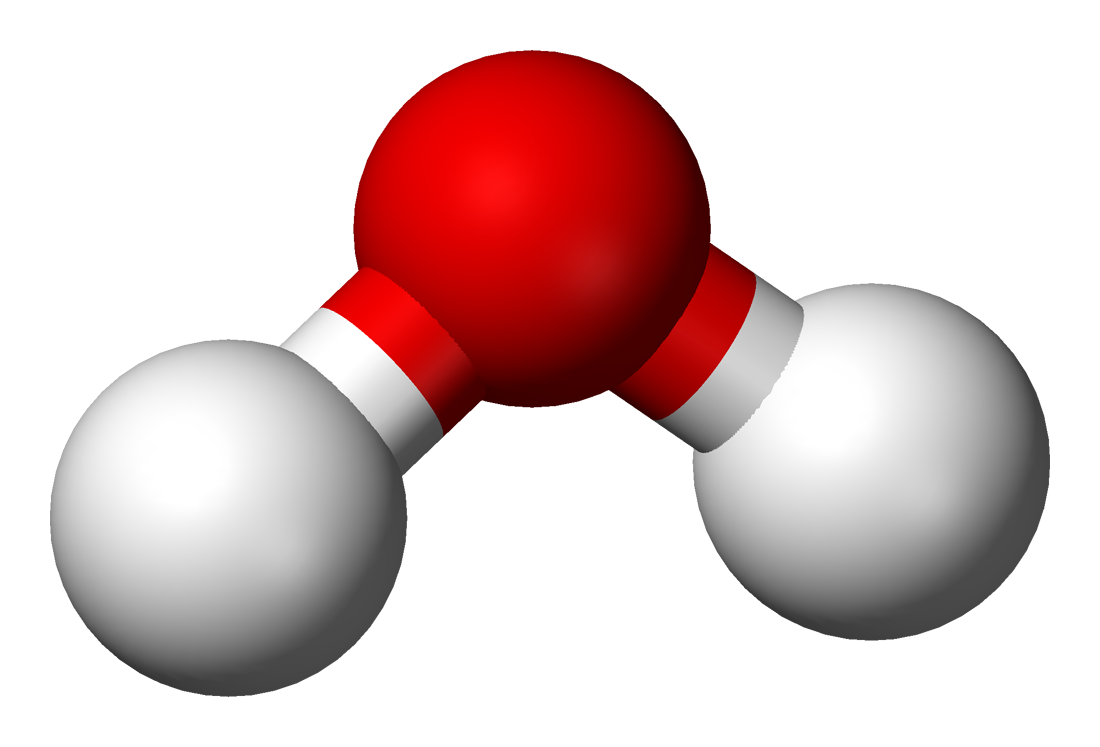
Der Sauerstoff im Wassermolekül zieht die negativen Elektronen stärker zu sich, sodass es eine leicht negative Ladung hat. Die beiden Wasserstoffmoleküle hingegen sind leicht positiv geladen. Diese Ladungsverteilung führt dazu, dass sich die Moleküle wie kleine Magnete verhalten – sie ziehen sich gegenseitig an und bilden die sogenannten Wasserstoffbrückenbindungen.
Diese Bedeutung des Dipol-Charakters erklärt viele der Besonderheiten von Wasser, wie zum Beispiel seine hohe Oberflächenspannung oder die Fähigkeit, viele Stoffe zu lösen. Ohne diesen speziellen Aufbau könnte Wasser nicht in verschiedenen Zuständen vorkommen oder seine wichtige Rolle in der Natur spielen.

Wasser als stabile chemische Verbindung
Die Stabilität des Wassers liegt in seiner einzigartigen chemischen Struktur und den starken Bindungen zwischen den Molekülen. Das Wassermolekül selbst wird durch kovalente Bindungen zusammengehalten, bei denen die beiden Wasserstoffatome ihre Elektronen mit dem Sauerstoffatom teilen. Diese Verbindung sorgt dafür, dass das Element Wasser in seiner Grundstruktur sehr stabil ist.
Eine zusätzliche Bedeutung für die Stabilität von Wasser haben die Wasserstoffbrückenbindungen. Diese Bindungen entstehen zwischen den leicht positiven Wasserstoffmolekülen eines Wassermoleküls und dem leicht negativen Sauerstoffatom eines benachbarten Wassermoleküls. Obwohl diese Bindungen schwächer sind als die kovalenten Bindungen, sind sie in großen Mengen sehr wirkungsvoll. Sie sorgen dafür, dass die Moleküle stark aneinander haften und Wasser seine besonderen Eigenschaften wie eine hohe Oberflächenspannung und einen hohen Siedepunkt hat.
Durch diese Wasserstoffbrückenbindungen bleibt Wasser stabil und kann in verschiedenen Zuständen wie flüssig, fest (als Eis) oder gasförmig (als Wasserdampf) existieren. Diese Stabilität spielt auch eine wichtige Rolle im Grundwasser und in den Ozeanen, wo Wasser in grossen Mengen vorkommt und lange Zeit stabil bleibt.
Besondere chemische und physikalische Eigenschaften von Wasser
Wasser hat besondere chemische und physikalische Eigenheiten, die es so einzigartig und unverzichtbar für das Leben machen. Eine dieser Eigenschaften ist die hohe Wärmekapazität. Das bedeutet, dass Wasser grosse Mengen an Energie aufnehmen und speichern kann, ohne dass sich seine Temperatur stark verändert. Diese Fähigkeit stabilisiert das Klima auf der Erde und spielt eine entscheidende Rolle in der Atmosphäre und den Ozeanen.
Chemische Formel: H₂O (zwei Wasserstoffatome, ein Sauerstoffatom)
Dipol-Molekül: Ungleiche Ladungsverteilung, Sauerstoff negativ, Wasserstoff positiv
Wasserstoffbrückenbindungen: Starke Bindungen zwischen Wassermolekülen
Hohe Wärmekapazität: Wasser speichert viel Wärme, ohne sich stark zu erhitzen
Oberflächenspannung: Hohe Spannkraft an der Wasseroberfläche, ermöglicht es Insekten, auf Wasser zu laufen
Dichteanomalie: Eis ist weniger dicht als flüssiges Wasser, daher schwimmt Eis
Lösungsmittel: Wasser löst viele Stoffe wie Salze und Zucker durch seine Polarität
pH-Wert: Reines Wasser hat einen neutralen pH-Wert von 7
Aggregatzustände: Fest (Eis), flüssig (Wasser), gasförmig (Wasserdampf) bei normalen Temperaturen auf der Erde
Eine weitere besondere Eigenschaft ist die Oberflächenspannung. Aufgrund der Wasserstoffbrückenbindungen ziehen sich die Wassermoleküle stark an, insbesondere an der Wasseroberfläche. Das ermöglicht es kleinen Insekten wie Wasserläufern, über die Wasseroberfläche zu gehen, ohne einzusinken. Diese hohe Oberflächenspannung zeigt, wie stark die Moleküle im Wasser miteinander verbunden sind.
Ein weiteres Phänomen ist die Dichteanomalie des Wassers. Normalerweise wird ein Element im festen Zustand dichter, aber bei Wasser ist es anders. Eis hat eine geringere Dichte als flüssiges Wasser, weshalb es schwimmt. Diese Eigenschaft ist für das Leben in Gewässern essenziell, da unter dem Eis das Wasser flüssig bleibt und so Fische und andere Lebewesen in kalten Zeiten überleben können.
Wasser ist chemisch gesehen eine neutrale Substanz, was durch seinen pH-Wert von 7 definiert ist. Der pH-Wert gibt an, wie sauer oder basisch eine Flüssigkeit ist. Reines Wasser hat einen pH-Wert von 7, was bedeutet, dass es weder sauer noch basisch ist. Diese neutrale Eigenschaft ist entscheidend für viele natürliche Prozesse. In der Atmosphäre oder in Trinkwasser kann der pH-Wert leicht variieren, wenn andere Elemente wie Kohlendioxid aus der Luft oder Mineralien aus dem Boden gelöst werden. Dennoch bleibt reines Wasser aufgrund seines neutralen pH-Werts eine wichtige Grundlage für das Leben und viele Reaktionen in der Natur.
Wasser als Grundbaustein des Lebens
Wasser ist der wesentliche Grundbaustein des Lebens und spielt eine zentrale Rolle in fast allen biologischen Prozessen. Ohne Wasser könnten die grundlegenden Funktionen des Lebens nicht ablaufen. Es ist nicht nur ein Medium, in dem chemische Reaktionen stattfinden, sondern auch ein Transportmittel für Nährstoffe, Abfallstoffe und andere lebenswichtige Substanzen.
In unseren Zellen, die zu einem Grossteil aus Wasser bestehen, ermöglicht Wasser den Transport von Nährstoffen und die Durchführung chemischer Prozesse. Es hilft bei der Aufrechterhaltung des Zellstoffwechsels, indem es die Reaktionen unterstützt, die für die Energiegewinnung und das Wachstum der Zellen notwendig sind. Ohne Wasser wären die komplexen Reaktionen im Stoffwechsel nicht möglich.
Ein weiteres Beispiel ist der Transport von Nährstoffen in Lebewesen. Im menschlichen Körper wird Wasser genutzt, um Nährstoffe über das Blut zu den Zellen zu transportieren und gleichzeitig Abfallstoffe abzutransportieren. Wasser spielt auch eine zentrale Rolle bei der Regulierung der Körpertemperatur, da es durch Verdunstung in der Atmosphäre Wärme ableiten kann.
Wasser macht etwa 60 Prozent des menschlichen Körpers aus und ist auch in Pflanzen von zentraler Bedeutung, da es Nährstoffe aus dem Grundwasser aufnimmt und durch die Pflanze transportiert. Ohne die Fähigkeit des Wassers, Nährstoffe zu lösen und zu transportieren, wäre das Leben, wie wir es kennen, nicht möglich.
Wasser und Ökosysteme
Das Wasser auf unserer Erde ist ein unverzichtbarer Bestandteil der Ökosysteme und spielt eine zentrale Rolle in terrestrischen und aquatischen Lebensräumen. In terrestrischen Ökosystemen ist Wasser oft der limitierende Faktor für die Produktivität. Pflanzen benötigen Wasser für das Wachstum und den Stoffwechsel, und Niederschläge speisen sowohl das Grundwasser als auch Gewässer, die als Trinkwasser für Tiere dienen. Ohne Wasser könnten viele biologische Prozesse nicht ablaufen, und die Biodiversität wäre stark eingeschränkt.
In aquatischen Ökosystemen, insbesondere in den Ozeanen, liegt der Fokus auf der Menge an gelösten Nährstoffen wie Phosphaten, Stickstoffverbindungen und Kohlendioxid (CO₂). Diese Nährstoffe sind für das Wachstum von Plankton und anderen Organismen essenziell. Hier zeigt sich die Bedeutung von Wasser in seiner vollen Menge, denn die meiste Biomasse auf der Erde findet sich in den Meeren.
Die Dichteanomalie von Wasser ist für das Überleben in Gewässern besonders wichtig. Sie sorgt dafür, dass Seen im Winter nicht komplett zufrieren und das Leben im Wasser bestehen bleibt. In tiefen Seen kommt es zudem durch die Dichteanomalie im Frühling und Herbst zu einer Umwälzung des Wassers, die den Nährstoff- und Sauerstoffkreislauf unterstützt.
Mit KI zusammenfassen:















